| 话述RNA药物递送技术及其应用 | 您所在的位置:网站首页 › sirna 上市药物 › 话述RNA药物递送技术及其应用 |
话述RNA药物递送技术及其应用
|
上市的RNA药物
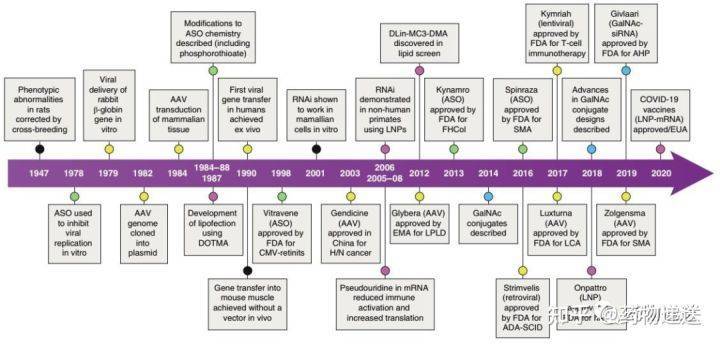
1998年上市首款ASO药物福米韦森Fomivirsen,用于治疗眼科疾病,尽管后来因临床需求减少而退市,但RNA药物自此开始活跃在生物医药的舞台上。2001年,干扰RNA(RNAi)技术更是被评《科学》杂志评为十大科学突破。然而,由于很难将完整的RNA递送至特定的细胞或组织,裸RNA药物并未取得重大进展。随着核酸化学修饰和递送系统的发展,RNA药物逐渐获得迅速发展。
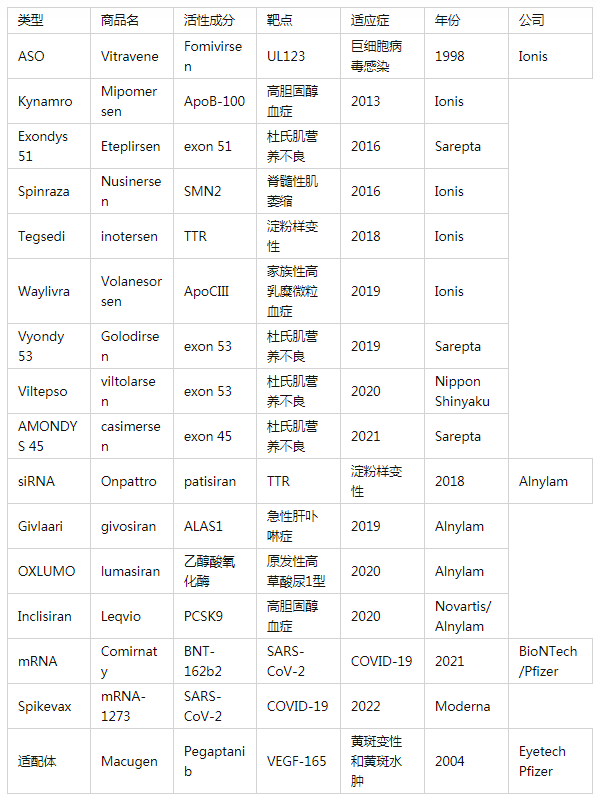
自首个siRNA药物Patisiran 2018年获批上市以来,RNA药物终于进入了快速发展阶段。2019年底,第二款siRNA药物Givosiran获批。现在,已有足够的研究表明脂质纳米粒用于递送编码COVID-19刺突蛋白的mRNA能出对肺部感染形成有效保护,RNA药物的商业潜力和临床价值终于得到了证实。 目前有9款ASO药物、4款siRNA药物和2款mRNA药物和1款RNA适配体药物上市,其中80%是2015年后上市的,适应症多为遗传疾病。还有更多类型的RNA药物正在临床试验中,包括相对较新的miRNA mimic、antimiRNA、小激活RNA(saRNA)等,相信在未来几年内将有更多的RNA药物实现临床转化。在已上市或处于临床试验中的RNA药物中,涉及的非病毒载体递送策略主要包括寡核苷酸化学修饰、LNP和GalNAc的共价偶联。
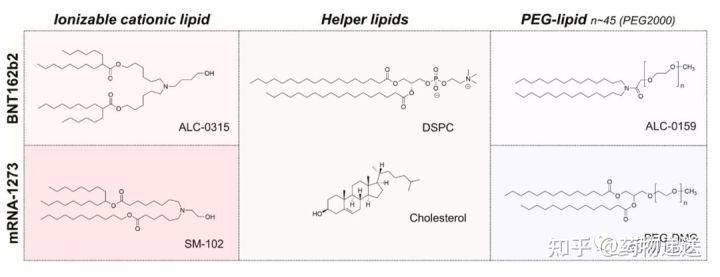
1、基于LNP的RNA药物 基于LNP的递送载体是目前最先进、最有前途的一种非病毒RNA药物递送系统,可用于治疗多种疾病。LNP由可电离或阳离子脂质、磷脂、聚乙二醇(PEG)化脂质和胆固醇组成。近年来,很多可电离脂质作为关键成分被用于LNP开发,以克服阳离子的诸多限制,进一步提高递送效率。这些可电离的脂类通常含有可电离的头部氨基,其酸度系数(pKa)小于7。因此,在pH < 6.0时,脂质中可电离的头部氨基会质子化并带正电荷,这使其在酸性条件下对RNA有很强的包载能力,而在生理条件下(pH=7.4)显电中性。与阳离子递送系统相比,在生理条件下显电中性的LNP降低了与正电荷相关的毒性,并延长了体内循环时间。递送到细胞的酸性内涵体后,可电离脂质被电离质子化,LNP结构遭到破坏,促进内涵体逃逸和RNA药物的释放到细胞质中,提高RNA转染效率。
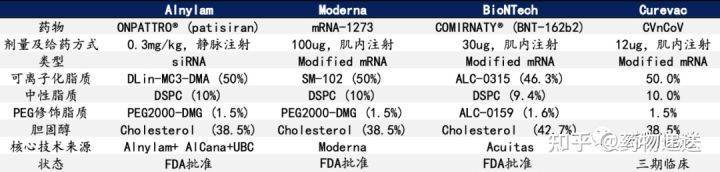
目前,已有3款基于LNP开发的RNA药物获批上市,包括Alnylam公司的的Patisiran(Onpattro)、BioNTech/Pfizer公司的BNT162b2(Comirnaty)和Moderna公司的mRNA-1273(Spikevax)。其中,Patisiran是siRNA药物,用于治疗严重而致命的罕见神经性疾病遗传性转甲状腺素蛋白淀粉样变性;BNT162b2和mRNA-1273则是针对COVID-19的mRNA疫苗。 Patisiran作为首个获批上市的siRNA药物,既是LNP的首次临床应用,也是首个非病毒载体用于基因药物递送。该药的上市,标志生物医药进入核酸纳米医学时代(The era ofnucleic acid nanomedicine)。
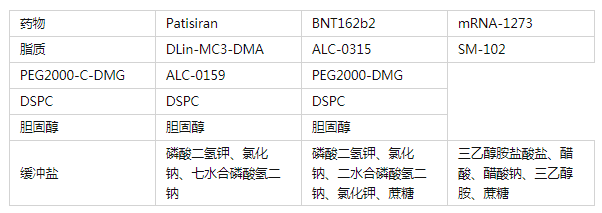
在研发过程中,Alnylam发现LNP/RNA递送系统的功能活性与所用可电离脂质的pKa密切相关。当可电离脂质头部氨基的pKa值在6.2 ~ 6.5之间时,在体循环中保持电中性,表现出良好的生物相容性,同时又在酸性条件下表现出足够的荷正电性,保证了对RNA药物的高包载性能。在已报道的可电离脂类中,基于DLin-MC3-DMA(二烯甲基-4-二甲氨基丁酸二烯酯,专利号:US8158601B2)的LNP是对siRNA最有效的递送系统。DLin-MC3-DMA的应用大大降低了siRNA的给药剂量,同时增加了siRNA在肝脏组织中的基因沉默效率。 在制备LNP的过程中,DLin-MC3-DMA在酸性条件下(pH= 4)带正电荷,可以高效包载带负电荷的siRNA药物。之后,随着溶剂体系的置换,溶液的pH值调节至生理pH=7.4,LNP的表面趋于电中性。胆固醇和DSPC(1,2-二硬脂酰-sn-甘油-3-磷脂酰胆碱)的引入可进一步提高LNP的稳定性。此外,聚乙二醇(PEG)化脂质的引入可以避免粒子团聚而增加储存稳定性。尽管PEG化纳米颗粒会间接影响LNP和细胞表面的相互作用,但在血液循环过程中,Patisiran所采用的含有短酰基链的PEG脂质(PEG- C14)会逐渐从LNP中分离出来。 经静脉给药后,Patisiran被内源性载脂蛋白E(ApoE)吸收,PEG表层的分离可以增强ApoE与LNP表面的结合。LNP在靶肝组织中蓄积后,由肝细胞表面的ApoE受体(如低密度脂蛋白受体)介导摄取。LNP进入肝细胞后,DLin-MC3-DMA在内涵体的低pH值环境下被质子化,并与带负电荷的内源性脂质相互作用,导致内涵体膜不稳定,实现对siRNA药物的释放。对于Patisiran来说,将siRNA释放到细胞质中,可以通过形成RNA诱导的沉默复合物(RISC)来沉默遗传转甲状腺素淀粉样变(hATTR)mRNA的表达,减少错误折叠TTR蛋白的产生。 Patisiran的主要不良反应为轻至中度输液相关反应,其发生率会随着时间的推移而降低。在III期临床试验中,在接受Patisiran的225名患者中,约20%出现了轻度或中度输液相关反应,而在接受安慰剂的患者也有10%的与输液有关的反应产生。 而对于后面获批上市的两款mRNA新冠疫苗,产品的设计思路和递送机制与Patisiran是一样的。
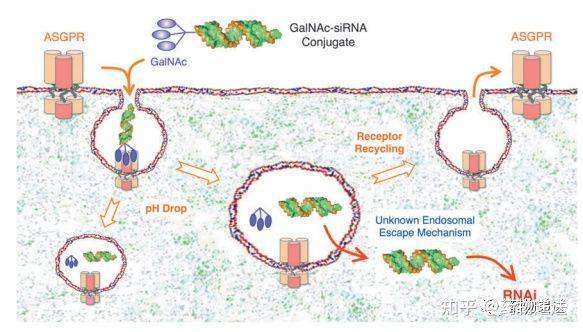
2、基于GalNAc偶联技术的siRNA药物 在目前获批上市的RNA药物中,有3款是基于GalNAc偶联技术递送siRNA药物的。上市的三款siRNA药物都是由Alnylam公司参与开发,分别是Givosiran、Lumasiran、和Inclisiran,其中Inclisiran是Alnylam公司和Novartis公司联合开发,三款产品在肝脏相关疾病的治疗上都具有显著性优势。siRNA药物的作用机制是与同源的靶RNA互补结合,特异性酶降解靶RNA,从而抑制、下调基因表达。 作为半乳糖氨基糖衍生物的GalNAc(N-乙酰半乳糖胺),是脱唾液酸糖蛋白受体(ASGPR)的高亲和力靶向配体。ASGPR在肝细胞表面特异性高表达,每个肝细胞约表达106,而其他受体在细胞表面仅表达104-105甚至更低。ASGPR的选择性与糖分子类型、触角数量、空间距离以及其他因素密切相关。最终优化了三触角型的GalNAc,并将其作为高亲和力的ASGPR靶向配体。除了因高表达的数量优势外,ASGPR也是一种非常高效的内摄取循环受体,其循环速率约为15min,而其他细胞表面可循环受体的循环时间通常为90min。鉴于ASGPR的数量多和循环时间短这两个优势,使GalNAc-siRNA偶联物能实现高效的细胞内在化。
GalNAc以三价态的方式共价偶联到siRNA的正义链3’末端,形成GalNAc-siRNA复合物。当GalNAc-siRNA复合物与ASGPR结合时,它可以通过网格蛋白介导的内吞作用进入内涵体。复合物进入早期内涵体(EarlyEndosomes,EE)后,ASGPR在低pH值下从GalNAc-siRNA结合物中分离,并返回肝细胞表面循环。随着早期内涵体的酸化和成熟,会逐渐转变成晚期内涵体(LateEndosomes)或多泡体(Multivesicularbody,MVB),仅有<0.01%的siRNA能从晚期内涵体或MVB中逃逸到胞质中,但高效的细胞摄取使得每15分钟有近100万个siRNA进入早期核内体,到达细胞质中的siRNA数量远远超过RNAi反应的阈值,能较好地满足给药需求,使短期的药物疗效成为可能。而将siRNA分子滞留在酸性环境中,是维持长期疗效的必要条件。研究表明,GalNAc-siRNA偶联物的长期作用是由于化学修饰后siRNA代谢稳定性增强,可大幅度提高siRNA在酸性环境中的存活率,并形成胞内siRNA储库。这些储库中的siRNA可以从酸性环境缓慢释放到细胞质中,然后装载到RISC中,延长GalNAc-siRNA偶联物的药理学持久性。 虽然LNP和GalNAc都能在肝脏很好的蓄积和摄取,但基于GalNAc开发的递送策略比LNP更有优势。首先,静脉注射LNP会引起输液相关反应,需要与抗组胺药、对乙酰氨基酚、地塞米松联合使用;而GalNAc偶联核酸药物可皮下给药,避免了使用LNP时由于脂质分子和PEG的免疫原性而引起的安全性问题。此外,相比于LNP,基于GalNAc开发的产品更易于规模放大生产,在给药剂量和频次方面也有优势。目前,虽然有很多基于LNP开发的核酸药物,但基于GalNAc偶联技术开发的RNA药物在临床试验中应用更为广泛。返回搜狐,查看更多 |
【本文地址】